Calendrier scientifique – décembre 2024
La leucémie aigüe myéloïde (LAM)
Quelles sont les caractéristiques des blastes dans le canal WPC après traitement par des réactifs ?
Les blastes ne sont pas fortement pénétrés par le réactif de lyse et présentent donc de faibles signaux de fluorescence et de forts signaux de taille de cellule.
Les blastes sont fortement lysés, ce qui provoque des signaux de fluorescence plus forts et des signaux de taille plus faibles.
Les blastes rétrécissent pendant le traitement par le réactif, ce qui produit des signaux de fluorescence faibles et des signaux de plus petite taille.
Congratulations!
That's the correct answer!
Sorry! That´s not completely correct!
Please try again
Sorry! That's not the correct answer!
Please try again
Notice
Please select at least one answer
Contexte scientifique
La leucémie aigüe myéloïde
La leucémie aiguë myéloïde (LAM) est le type de leucémie aiguë le plus courant chez les adultes et se caractérise par la prolifération clonale de cellules précurseurs myéloïdes dans la moelle osseuse [1]. C’est en Europe, en particulier au Royaume-Uni, que l’on observe l’incidence de LAM la plus élevée, avec une incidence de 4,05 pour 100 000 personnes. Cependant, la LAM est considérée comme une maladie rare et touche principalement les personnes âgées [1]. Dans 97 % des cas de LAM, des altérations génétiques apparaissent dans les précurseurs des cellules souches de la lignée myéloïde, entraînant des changements néoplasiques et une prolifération clonale [2]. Ces mutations sont hétérogènes et présentent des anomalies cytogénétiques et moléculaires très diverses dans différentes classes fonctionnelles [3]. L’OMS a défini un seuil de diagnostic de LAM consistant en la présence d’au moins 20 % de blastes myéloïdes dans le sang périphérique ou la moelle osseuse [4]. Le diagnostic et la surveillance de la LAM nécessitent une approche globale comprenant des analyses hématologiques et morphologiques, une cytométrie en flux clinique et des tests moléculaires.
Détection de blastes avec les canaux WDF et WPC de Sysmex
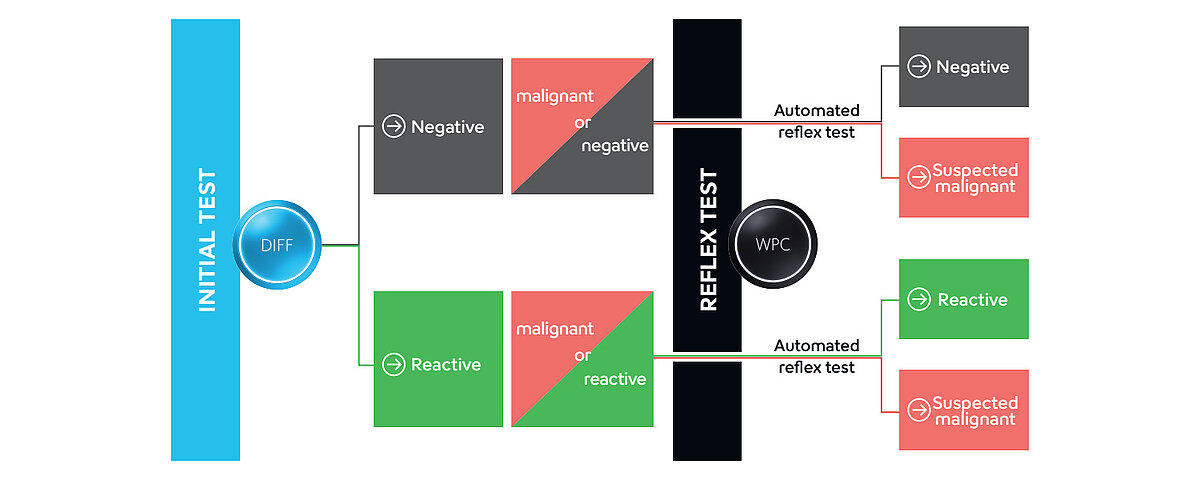
L’analyse classique CBC+DIFF sur les analyseurs hématologiques de routine Sysmex fournit une première indication de la présence de cellules anormales. Cette analyse peut être complétée par de l’information supplémentaire recueillie via le canal « précurseurs des globules blancs et cellules pathologiques » (WPC).
Les membranes des globules blancs (WBC) présentent une composition différente selon la maturité, la fonction et l’état d’activation de ces cellules. Le canal de la formule leucocytaire (WDF) utilise un marqueur de fluorescence qui peut séparer les sous-types de globules blancs en fonction de ces différences de composition membranaire et de contenu cytoplasmique. Le réactif de lyse réagit plutôt doucement, en perforant la membrane cellulaire et en laissant la structure interne des cellules en grande partie intacte. Cela permet au marqueur de fluorescence de pénétrer dans la cellule et de marquer principalement l’ARN. En fonction du signal de fluorescence des amas de cellules, des drapeaux spécifiques sont déclenchés, préclassant l’échantillon comme négatif, réactif ou potentiellement malin. Sur la base de cette pré-classification dans le canal WDF, le drapeau « Blasts/Abn Lympho? » ou la combinaison de drapeaux « Blasts/Abn Lympho? » et « Atypical Lympho? » peut être déclenché, conduisant à une mesure réflexe automatisée dans le canal WPC (fig. 1).
Par rapport au canal WDF, le réactif de lyse du canal WPC a un impact plus fort sur les lipides membranaires, ce qui entraîne une perméabilité plus élevée de la membrane cellulaire. La concentration en polyméthine du réactif de fluorescence WPC étant supérieure à celle du canal WDF, il marque l’ADN à l’intérieur du noyau au lieu de l’ARN cytoplasmique. Les caractéristiques particulières des différents globules blancs (WBC) peuvent être utilisées pour la différenciation des sous-populations, par exemple entre les lymphocytes anormaux et les cellules blastiques (fig. 2).
La LAM se caractérise par la présence de cellules blastiques de la lignée myéloïde. Les cellules blastiques présentent une faible composition lipidique, ce qui les rend plus résistantes à la lyse cellulaire – même par le puissant réactif de lyse WPC. La perméabilité cellulaire est réduite et se traduit par un signal de fluorescence plus faible combiné à un signal élevé pour la taille des cellules, étant donné que les cellules restent pour la plupart intactes. Ces caractéristiques permettent une identification fiable des cellules blastiques dans le canal WPC.
Les échantillons étiquetés par un drapeau lors de la mesure WDF subissent une analyse réflexe, suite à quoi soit l’anomalie est classée plus en détail par un drapeau plus spécifique (par exemple « Blast? » ou « Abn Lympho? »), soit le drapeau est complètement supprimé.
Les échantillons dont l’analyse conduit à une suspicion de maladies hématologiques malignes telles que la LAM font l’objet d’une analyse plus spécialisée. Grâce à l’immunophénotypage par cytométrie en flux, les cellules suspectes sont caractérisées plus en détail en utilisant les marqueurs de surface et intracellulaires spécifiques de ces cellules. Un laboratoire moléculaire est capable d’évaluer des mutations spécifiques par des techniques cytogénétiques telles que l’hybridation in situ en fluorescence (FISH – Fluorescence In Situ Hybridisation) et le séquençage de nouvelle génération (NGS – Next-Generation Sequencing).
L’inclusion de ces disciplines permet aux cliniciens de combiner les données de divers tests, ce qui conduit à une compréhension globale de l’état du patient et à l’identification d’une stratégie de traitement ciblée personnalisée et efficace.
Résultats de cas
Une patiente de 70 ans suivait plusieurs cycles de chimiothérapie et de radiothérapie pour un cancer bronchique non à petites cellules. Elle s’est présentée dans une clinique externe après avoir développé un malaise et une diminution marquée de ses capacités physiques. L’analyse sanguine sur un analyseur de la série XR a initialement révélé une anémie, une thrombocytopénie et une légère leucocytose (fig. 3).
Le drapeau « IG Present » a été déclenché dans le canal WDF. La numération des granulocytes immatures (IG) comprend les promyélocytes, les myélocytes et les métamyélocytes ; ce comptage est particulièrement pertinent chez les patients très sensibles aux infections en raison d’un système immunitaire affaibli, par exemple du fait d’une chimiothérapie. La présence de granulocytes immatures indique la gravité de la réponse immunitaire innée précoce.
De plus, l’analyseur a déclenché le drapeau « Blasts? » du canal WPC et le scattergramme correspondant a montré une présence accrue de cellules dans la zone des blastes (fig. 4). Ce résultat est révélateur de la présence de tumeurs malignes aiguës, telles qu’une leucémie myéloïde ou lymphoblastique.
Un examen du frottis a ensuite été effectué pour inspecter la morphologie des cellules et effectuer leur numération, révélant 75 % de cellules blastiques. L’immunophénotypage ultérieur au laboratoire clinique de cytométrie en flux a confirmé la suspicion de LAM.
Références
[1] Dong Y et al. (2020): Leukemia incidence trends at the global, regional, and national level between 1990 and 2017. Exp Hematol Oncol; 9:14.
[2] Pelcovits A et al. (2020): R I Med J; 103(3). Acute Myeloid Leukemia: A Review.
[3] Kayser S et al. (2023): The clinical impact of the molecular landscape of acute myeloid leukemia. Haematologica; 108(2):308–320.
[4] Khoury JD et al. (2022): The 5th edition of the World Health Organization Classification of Haematolymphoid Tumours: Myeloid and Histiocytic/Dendritic Neoplasms. Leukemia; 36(7), 1703–1719.