Calendrier scientifique – juin 2024
Présence d’hémoglobine instable
Quel scattergramme donne des résultats erronés dans le cas d’une variante de l’hémoglobine ?
Le scattergramme WNR
Le scattergramme WDF
Le scattergramme RET
Le scattergramme PLT-F
Congratulations!
That's the correct answer!
Sorry! That´s not completely correct!
Please try again
Sorry! That's not the correct answer!
Please try again
Notice
Please select at least one answer
Contexte scientifique
Les variantes de la molécule d’hémoglobine font partie des troubles génétiques les plus courants [1]. Alors que la majeure partie des plus de 1200 variantes connues de l’hémoglobine (Hb variantes) n’ont aucun effet clinique, il a été établi pour environ 150 Hb variantes instables qu’elles provoquent une anémie hémolytique de gravité variable [2].
Au niveau moléculaire, les Hb variantes proviennent généralement d’échanges d’un seul acide aminé de la protéine globine, produisant des différences de structure et de propriétés biochimiques (telles que l’affinité pour l’oxygène) de la molécule d’hémoglobine. Les mutations entraînant des molécules d’hémoglobine instables sont considérées comme des événements individuels rares. Par convention, ces variantes portent le nom de l’origine géographique de l’individu affecté, et la plupart d’entre elles sont stockées dans une base de données génétique mondiale. Les effets physiologiques de ces Hb variantes peuvent aller de conditions cliniquement silencieuses à une maladie grave [2,3].
De nombreux pays ont mis en place des tests de routine pour tous les nouveau-nés afin d’identifier les hémoglobinopathies courantes. La focalisation isoélectrique ou la chromatographie liquide à haute performance (HPLC) sont les tests les plus utilisés et permettent d’identifier la plupart des hémoglobines structurellement anormales. De nombreuses Hb variantes bénignes sont ainsi découvertes accidentellement [3].
Dans le présent cas du mois, nous présentons les résultats de mesure d’un patient présentant la variante « Hb G Ferrara », initialement décrite dans une famille italienne [4]. Depuis lors, elle a été décrite dans différents rapports de cas comme une variante d’hémoglobine légèrement instable [5 – 6]. Dans cette Hb variante, un résidu asparagine est remplacé par un résidu lysyl en position β57 (β57 Asn → Lys), ce qui conduit à une modification de la structure et des propriétés de la protéine et à l’introduction d’une charge positive additionnelle qui modifie la charge nette de la protéine [4 – 6].
Les examens des frottis sanguins de patients porteurs de l’Hb G Ferrara montrent une morphologie altérée des globules rouges (RBC), telle que des globules rouges et des cellules cibles de forme irrégulière [5].
Résultats de cas
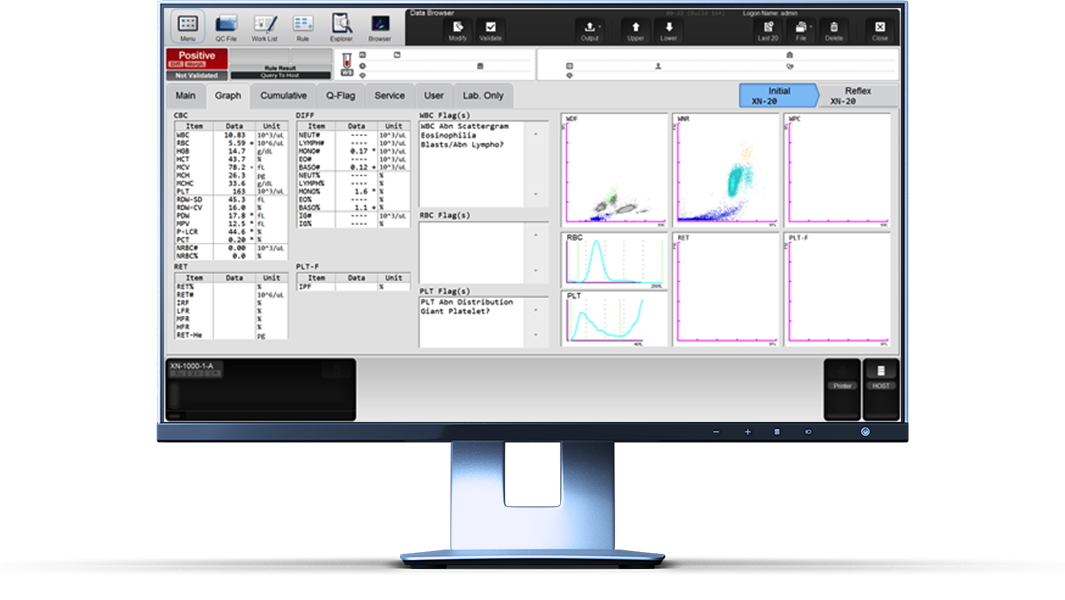
Un patient de sexe masculin s’est présenté chez son médecin généraliste pour un contrôle de routine. La formule sanguine complète semblait pour l’essentiel normale, à l’exception d’un hématocrite légèrement réduit et d’une augmentation du RDW-CV ayant déclenché le message d’avertissement « Anisocytose ». Une faible CCMH a déclenché le message d’indicateur « Hypochromie ».
Curieusement, le scattergramme WDF indiquait que toutes les sous-populations de globules blancs (WBC) avaient des signaux de fluorescence très faibles apparaissant à l’extrémité inférieure du scattergramme. Par conséquent, l’analyseur de la série XN a déclenché le signal « WBC Abn Scattergram » et a souligné le positionnement anormal des amas cellulaires.
Interprétation du scattergramme
Il a été observé que l’analyse du canal WDF des analyseurs Sysmex de la série XN est affectée en cas d’anomalies de l’hémoglobine. L’analyse montrait également des faibles signaux de fluorescence entraînant une position basse des amas, ce qui donnait des amas cellulaires partiellement grisés. Les scattergrammes du canal WNR n’étaient cependant pas affectés [7 – 10]. Bien que la cause de cette altération du canal WDF ne soit pas entièrement expliquée, on émet l’hypothèse que la libération d’hémoglobine instable lors de la lyse des RBC pourrait interférer avec le processus de coloration des WBC par le réactif fluorescent [7]. Une explication possible pourrait être que le marqueur fluorescent polyméthine, utilisé dans les analyseurs hématologiques de Sysmex pour la différenciation des WBC, pourrait se lier à la molécule d’hémoglobine variante avec une plus grande affinité qu’aux acides nucléiques des WBC [9]. Les observations microscopiques d’échantillons de sang affectés n’ont montré aucune altération des populations de WBC [8, 9].
Des études ont suggéré que ce schéma indique clairement la présence d’une variante de l’hémoglobine et devrait déclencher une analyse plus approfondie [7, 8, 10]. Combulazier et al. ont étudié plusieurs patients présentant différentes variantes d’hémoglobine instables et ont découvert que les paramètres de fluorescence latérale des lymphocytes (LY-SFL ; équivalent à LY-Y) et de fluorescence latérale des neutrophiles (NE-SFL) démontraient une excellente sensibilité et spécificité. Cela leur a permis de classer 100 % des patients atteints d’une variante d’hémoglobine instable dans leur cohorte d’étude [9].
L’effet visible sur le scattergramme WDF peut avoir différentes intensités, comme le montre la fig. 2. Un point commun qui peut être noté est un faible signal de fluorescence de tous les amas cellulaires. Néanmoins, l’amas peut encore être totalement, partiellement (A et D) ou pas du tout (B et C) grisé, ou l’analyse d’amas peut être perturbée (C).
Références
[1] Wajcman H et al. (2011): Abnormal haemoglobins: detection & characterization. Indian J Med Res. 134. pp 538 – 546.
[2] Hilbert S et al. (2020): Hemolytic anemia due to the unstable hemoglobin Wien: manifestations and long-term course in the largest pedigree identified to date. Haematologica. 105(5): e253–e255.
[3] Thom CS et al. (2013): Hemoglobin Variants: Biochemical Properties and Clinical Correlates. Cold Spring Harb Perspect Med. 3:a011858.
[4] Giardina B et al. (1978): Properties of hemoglobin G. Ferrara (β57(E1) Asn → Lys). Biochim Biophys Acta. 534(1): 1-6.
[5] Rosetti M et al. (2016): Serendipitous detection of Hemoglobin G-Ferrara variant with Sysmex DIFF channel. Clin Biochem. 49(1-2): 192-3.
[7] Adam AS et al. (2022): Rare unstable and low oxygen affinity haemoglobin variant, Hb Hazebrouck, detected on Sysmex XN-9000. Clin Chem Lab Med; 60(5): e116-e118.
[8] Moioli V et al. (2019): Mozhaisk haemoglobin variant effects on leukocyte differential channel using the Sysmex XN series. Clin Chem Lab Med. 57(12): e324-e327.
[9] Combaluzier S et al. (2023): Detection of unstable haemoglobin variants with Sysmex XN-10. Int J Lab Hematol; 45(2): e21-e23.
[10] Jongbloed W et al. (2018): Unstable haemoglobin variant Hb Leiden is detected on Sysmex XN-Series analysers. Clin Chem Lab Med. 56(9): e249–e250.